
细胞衰老是个体衰老的原因之一,也是一种重要的抑癌机制,因此理解细胞衰老的分子调控机制具有重要的基础研究和医学价值。2020年12月4日,衰老研究领域的国际知名期刊Aging Cell在线发表了复旦大学生命科学学院、人类表型组研究院倪挺教授课题组题为“Prevalent intron retention fine-tunes gene expression and contributes to cellular senescence”的研究论文。该研究发现在多个细胞衰老体系中大量基因的成熟转录本存在内含子保留现象,进而筛选并验证了剪接因子U2AF1的表达水平下调使靶基因CPNE1的内含子保留水平上升,并通过RNA降解引起蛋白水平下降,从而导致细胞衰老相关表型。
真核生物的基因绝大部分都由外显子和内含子组成,在基因转录出前体信使RNA并成熟的过程中,内含子通常被切除,而侧翼外显子则拼接在一起。但在特殊情况下,这些内含子不被切除(即内含子保留),从而带来意想不到的生物学效应。内含子保留是动物中知之甚少的可变剪接形式,其在基因组上的广泛性和参与生理病理过程的重要性也常常被低估。
在以往的研究中,科学家发现细胞及组织衰老中出现了内含子保留的动态变化。但是,这些动态变化的内含子保留对细胞衰老表型的影响仍不清楚。在本研究中,倪挺课题组通过系统分析多个人源复制性细胞衰老模型的RNA-seq数据,发现882个在细胞衰老中呈持续上调或持续下调的内含子保留事件,并且内含子保留水平与基因的稳态表达量呈负相关。课题组整合多种类型的数据进行分析,锁定了剪接因子U2AF1,并且发现敲低该基因可引起转录组层面的内含子保留改变和细胞衰老表型。U2AF1敲低诱导的内含子保留水平亦与相应基因稳态表达量呈显著负相关。课题组进一步研究发现,U2AF1可直接结合下游靶基因CPNE1的内含子与外显子交接处来调控该基因的内含子保留,进而诱发细胞衰老相关表型。课题组还发现,这一调控规律在不同年龄的人皮肤成纤维细胞衰老中也成立。
总的来说,这一研究通过“干湿结合”的实验手段,揭示了细胞衰老过程中内含子保留变化及其调控规律,为理解细胞衰老及衰老相关疾病的调控机制提供了新的视角,也为细胞衰老及个体衰老表型的干预提供了潜在新靶点。
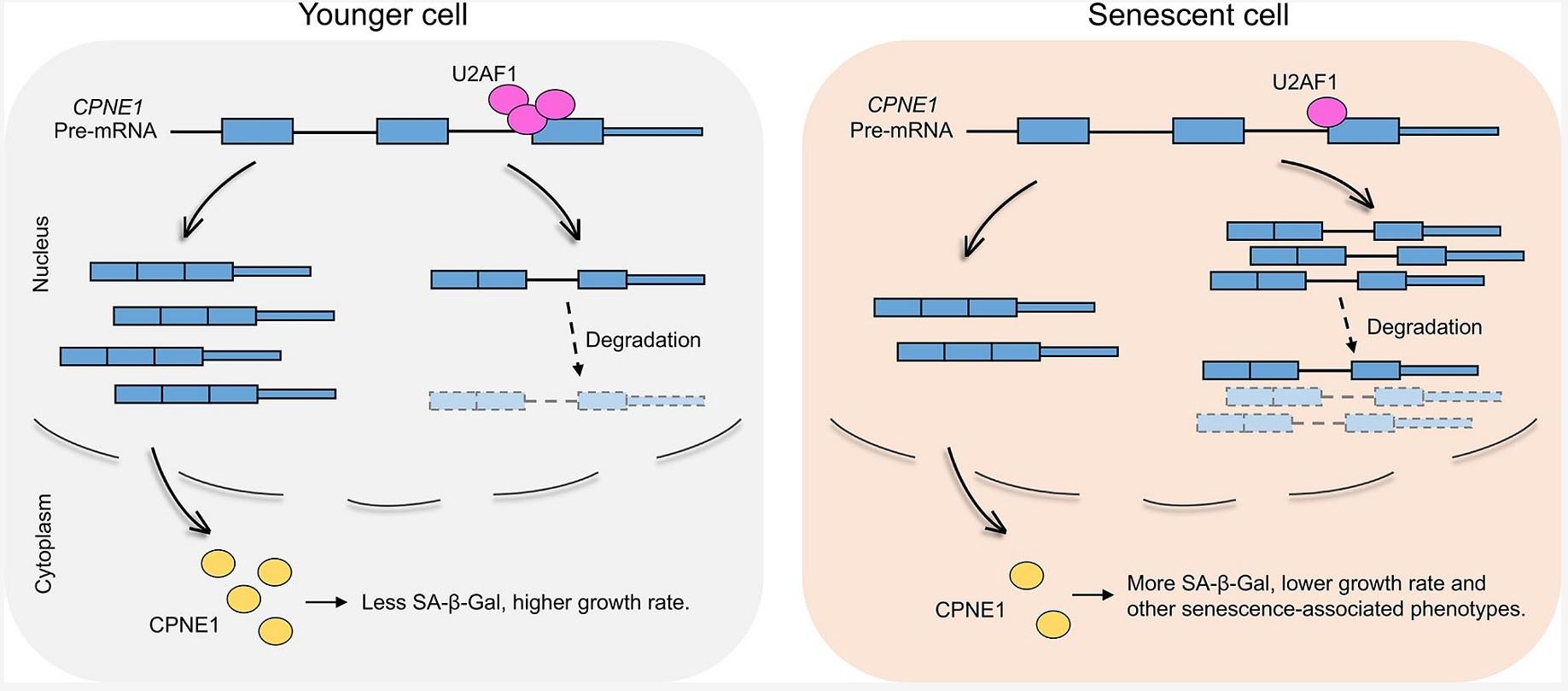
剪接因子U2AF1介导的内含子保留调控细胞衰老的模式图
复旦大学生命科学学院及人类表型组研究院倪挺课题组博士生姚钧(生命科学学院)、丁冬(人类表型组研究院)为本文共同第一作者,倪挺教授和生命科学学院魏刚博士为论文共同通讯作者。纽约大学医学院钟华教授在生物统计方面亦给予了重要指导。该研究获得国家重点研发计划课题、国家自然科学基金项目及上海市首批市级科技重大专项“国际人类表型组计划(一期)”的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1111/acel.13276
 新闻动态 News
新闻动态 News
 科研进展Research Progress
科研进展Research Progress
 学术报告Academic Report
学术报告Academic Report


