近日,我院PI王久存教授和美国马歇尔菲尔德临床研究所合作,发现新的调控铁代谢的基因FGF6,为阐明机体铁代谢调控的机制提供了新的方向。2月27日,相关研究成果以《一种基于基因隐性二倍体的外显子算法发现FGF6是新的铁调素调控基因》(A gene-based recessive diplotype exome scan discovers FGF6, a novel hepcidin-regulating iron metabolism gene)为题在线发表于《血液》(Blood)杂志。
铁是人体正常生命活动必不可少的微量元素之一,其在氧气运输、细胞代谢、DNA合成及免疫调控中起着重要作用。铁代谢异常可引起一系列疾病的发生,其中遗传性血色病(Hemochromatosis)是一类典型的由基因突变引起的铁过载疾病;铁超载会导致全身各器官铁的沉积,是引发癌症、风湿免疫病及神经退行性疾病等多种疾病的重要诱因。铁代谢紊乱引起的一系列疾病已逐渐成为困扰人们的营养问题和医学问题。
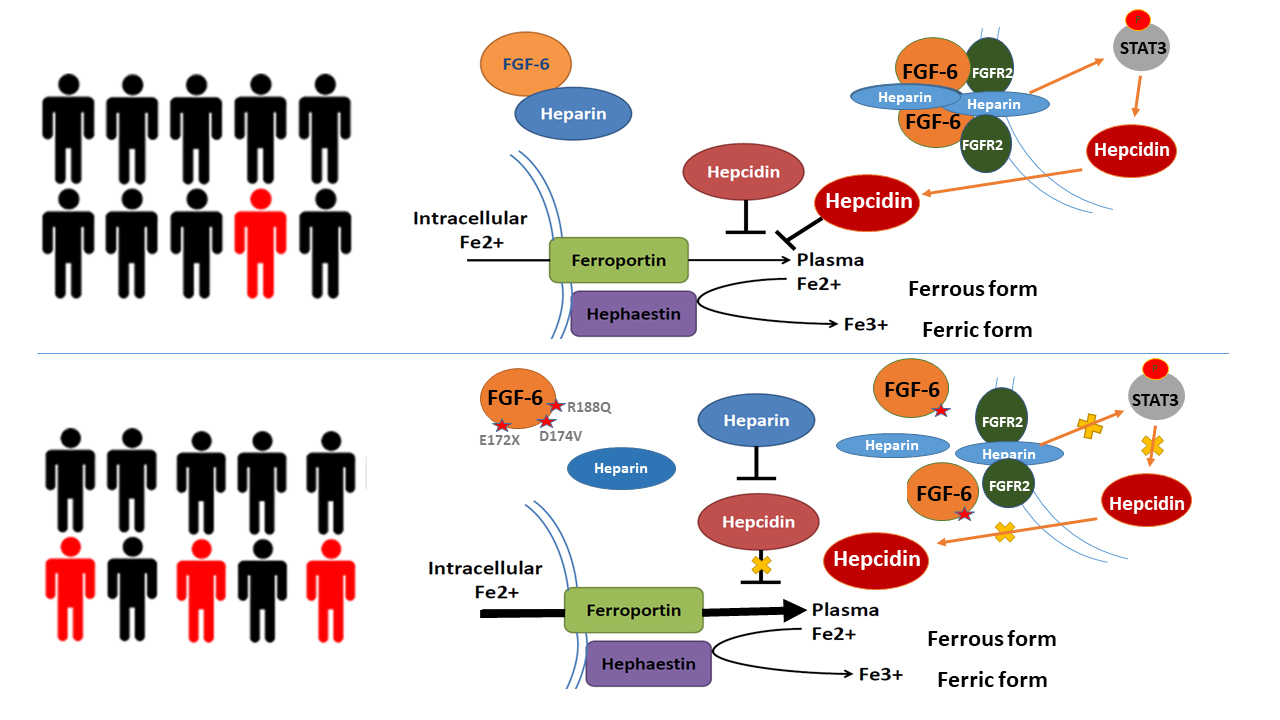
(图1. FGF6通过调控铁调素参与铁代谢的模型)
基于马什菲尔德诊所个性化医学研究项目(Marshfield Clinic Personalized Medicine Research Project,PMRP)中7000余例队列人群的外显子芯片数据,马歇尔菲尔德临床研究所的研究人员利用隐性二倍体模型,对血色病这一经典的铁离子过载疾病进行遗传关联分析,发现除HFE这一已明确与血色病密切相关的基因外,FGF6基因的多个突变位点(E172X、D174V和R188Q)也与血色病显著相关。王久存课题组功能研究发现,FGF6可促进铁代谢内稳态调控的关键基因HAMP的表达,抑制细胞对铁离子的吸收;而FGF6突变体则因丧失对HAMP基因和铁吸收的调控能力,引发铁代谢异常进而引起血色病的发生。项目组进一步在肝细胞癌和硬皮病的皮肤组织中发现存在FGF6表达降低与铁超载现象,提示FGF6可能通过调控机体铁代谢通路参与了多种复杂疾病的发生。该项研究为铁代谢异常的调控机制提供了新的思路,也为进一步揭示癌症和硬皮病等复杂疾病的致病机制提供了新的方向。
王久存课题组长期致力于硬皮病的遗传学及分子机制研究,基于本研究的结果,课题组将继续对硬皮病中铁离子代谢异常的机制及其在硬皮病发病中的作用进行深入探索,以期早日阐明硬皮病的发病机制。
马歇尔菲尔德临床研究所博士后郭士成博士(王久存-金力课题组2015年毕业博士生)和王久存课题组博士研究生姜帅为本文的共同第一作者,复旦大学王久存教授、马歇尔菲尔德临床研究所Steven J. Schrodi教授为共同通讯作者。该研究还得到了苏州大学医学院王明华教授课题组的大力支持,并获得了国家自然科学基金等项目的资助。
论文链接:http://www.bloodjournal.org/content/early/2019/02/27/blood-2018-10-879585
 新闻动态 News
新闻动态 News
 科研进展Research Progress
科研进展Research Progress
 学术报告Academic Report
学术报告Academic Report


