高原病(mountain sickness)是由平原进入高原(海拔3000米以上,对机体产生明显生物效应的地区),由于对低氧环境的适应能力不全或失调而发生的综合征。急性高原病会发展为高原肺水肿或高原脑水肿;长期处于高原低氧环境发生慢性缺氧,肺循环阻力增加产生肺动脉高压、心肌缺氧会导致右心肥大和心力衰竭症状的高原心脏病。为保障高原旅游和支边人员的身体健康等重大需求,阐明高原发病过程中机体生理、生化变化规律和机制、发现新靶标、并研制新型预防或治疗药物具有重要意义。
复旦大学人类表型组研究院在张江校区已建成了国内领先的环境模拟动物舱,拥有三套独立运行的环境模拟系统,可以实现低压、低氧、温度、湿度、和光照等多环境参数复合模拟,为研究高原疾病表型的发生发展机制,以及进一步的新药研发搭建了高水平研究平台。

复旦大学人类表型组研究院刘新华研究员团队利用环境模拟舱平台对机体稳态及急慢性高原病开展跨尺度多维度研究,近期发现铁调素介导低压低氧暴露小鼠肝脏铁稳态和线粒体功能紊乱,并调节异常血细胞指标和代谢紊乱,表明铁调素可能改善高原生理功能(Apoptosis. 2025);发现低压低氧环境加重了Th17细胞介导的自身免疫性疾病,阐明缺氧触发Activin A表达及释放,从而促进Th17关键转录因子及效应细胞因子激活的主要机制(FASEB J. 2025)。
近日,刘新华研究员团队在Redox Biology期刊上发表了题为“Hypobaric hypoxia-driven energy metabolism disturbance facilitates vascular endothelial dysfunction”的研究论文。该团队借助环境模拟舱平台联合多组学研究,揭示了低压低氧环境下能量代谢紊乱与内皮功能障碍的联系,并深入探究了分子机制,为研究缺氧介导的内皮功能障碍提供了新思路。

该团队发现,缺氧介导内皮功能障碍和能量代谢紊乱,进一步通过靶向代谢组学、转录组学和细胞能量代谢检测发现,缺氧导致内皮细胞糖酵解增加,氧化磷酸化降低。通过使用不同靶向药物抑制内皮细胞糖酵解通量可以缓解缺氧导致的内皮功能障碍,揭示了丙酮酸-乳酸轴通过调节内皮细胞能量代谢介导缺氧引起的血管内皮功能障碍。发现缺氧产生的大量乳酸,使PKM2乳酸化抑制其降解,从而增强内皮细胞能量代谢紊乱,加剧内皮功能障碍;而靶向丙酮酸-乳酸轴的调节可以维持糖酵解和氧化磷酸化之间的平衡,以保护血管内皮功能,该团队也利用高原环境模拟舱平台在体内对分子机制进行了验证。
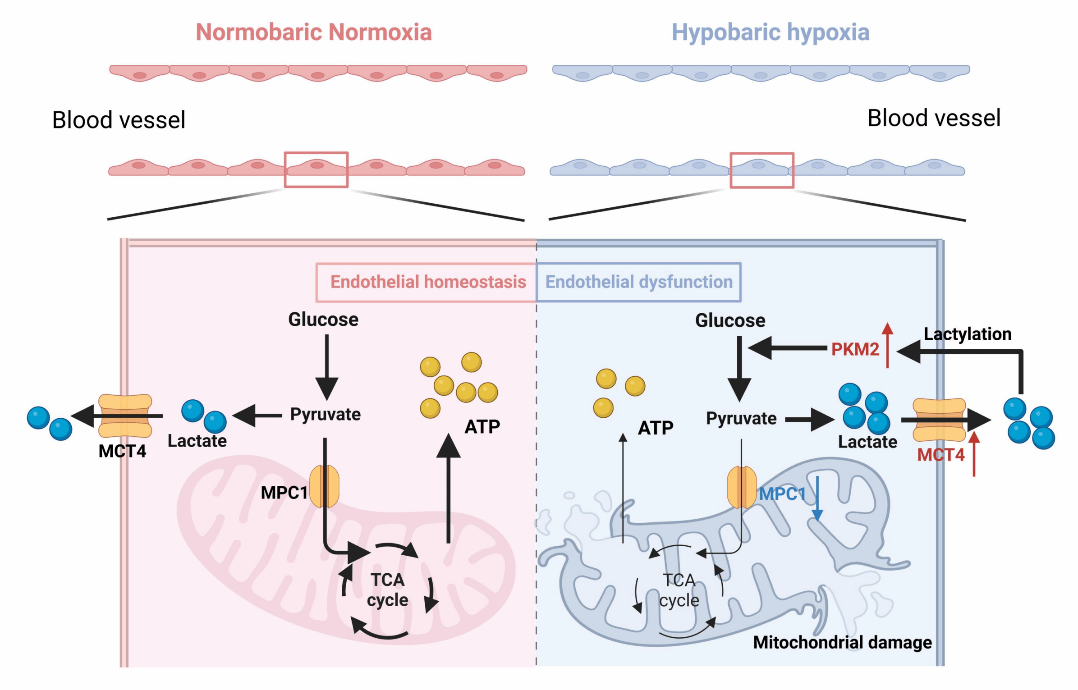
该研究具有重要的临床意义,为维持血管功能稳定性,预防高原和病理性缺氧相关的血管疾病提供了新的思路。
复旦大学人类表型组研究院刘新华、昌军研究员和附属浦东医院范春香主任医师为该研究共同通讯作者。复旦大学人类表型组研究院博士生张雨雨、博士后王静欢和硕士生贺梦婷为共同第一作者。
该项工作获得了国家重点研发计划等基金资助。
复旦大学环境模拟动物舱平台长期对外开放,提供共享服务,期待合作!
平台负责人:刘新华研究员 Email: liuxinhua@fudan.edu.cn。
 新闻动态 News
新闻动态 News
 科研进展Research Progress
科研进展Research Progress
 学术报告Academic Report
学术报告Academic Report


